Nuvaring
Nuvaring nedir?
 Nuvaring, uygulaması çok kolay, yeni geliştirilmiş, güvenilir, içinde hormon içeren, ince, yuvarlak, esnek bir gebelikten korunma halkasıdır.
Nuvaring, uygulaması çok kolay, yeni geliştirilmiş, güvenilir, içinde hormon içeren, ince, yuvarlak, esnek bir gebelikten korunma halkasıdır.
Nuvaring gebelikten korunma (kontrasepsiyon) amacıyla vajina içine adetin ilk günü yerleştiriliyor, adetin 21. günü ise içeriden alınıyor.
Aynı ağızdan alınan doğum kontrol hapları (oral kontraseptifler) gibi, fakat daha düzenli bir şekilde hormon salınımı yaparak bir ay boyunca gebelikten koruyucu özelliğe sahiptir.
Her gün dengeli hormon salınımı nedeni ile doğum kontrol haplarındaki gibi ara kanama riski çok daha düşük yeni ve alternatif bir korunma yöntemidir.
Düzenli hormon salınımı nedeni ile doğum kontrol haplarındaki adet düzensizlikleri Nuvaring ile olmamaktadır. Çünkü 24 saatte bir alınan doğum kontrol haplarında bazen adet düzensizliği şikayetleri ortaya çıkmaktadır.
Vajina içine kolay bir şekilde derine yerleştirilen Nuvaring cinsel ilişki sırasında erkek eş tarafından da hissedilmemektedir.
Nuvaring vajina içerisine nasıl yerleştirilir?
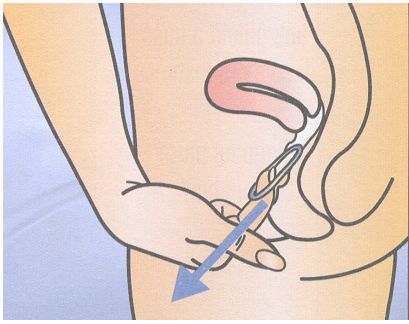 Nuvaring bir bacağı kaldırma, çömelme ya da uzanma pozisyonlarından birisinde kişinin kendisi veya bir jinekolog tarafından adetin 1. günü vajina içerisine derine yerleştirilir, adetin 21. günü çıkartılır.
Nuvaring bir bacağı kaldırma, çömelme ya da uzanma pozisyonlarından birisinde kişinin kendisi veya bir jinekolog tarafından adetin 1. günü vajina içerisine derine yerleştirilir, adetin 21. günü çıkartılır.
Vajina içine yerleştirilmesi son derece kolay, ağrısız ve zahmetsizdir. Ayrıca cinsel ilişki sırasında da partner tarafından hissedilmez.
Bazen ilk uygulama jinekolog hekim tarafından yapıldıktan sonra diğer kullanımlar kişinin kendisi tarafından rahatlıkla yapılabilmektedir.
Nuvaring aynı doğum kontrol hapları gibi etkilidir...
Gebelikten koruyucu halka çıkarıldıktan 2-3 gün sonra (aynı doğum kontrol haplarında olduğu gibi) adet kanaması başlayacaktır.
Yeni takılacak halka, son çıkarılan halkadan tam 7 gün sonra vajina içerisine yerleştirilir. Halkasız geçen bu 7 gün süresince gebelik olasılığı bulunmamaktadır.
Nuvaring'in gebelikten koruma mekanizması ise aynı doğum kontrol haplarında olduğu gibidir.
Aşağıda Nuvaring ile ilgili prospektus bilgileri bulunmaktadır.
NUVARİNG PROSPEKTUS BİLGİLERİ
NuvaRing 1.7 mg etonogestrel ve 2.7 mg etinilestradiol içerir.
NuvaRing 3 haftalık bir dönemde, sırasıyla günde ortalama 0.120 mg ve 0.015 mg etonogestrel ve etinilestradiol salmımı yapar.
Diğer bileşenler: Halka başına, 1677 mg etilenvinilasetat kopolimer (%28 VA), 197 mg etilen-vİnilasetat kopolimer (%9 VA), 1.7 mg magnezyum stearat ve saf su.
FARMAKOLOJİK ÖZELLİKLER
NuvaRing etonogestrel ve etinilestradiol içerir.
Etonogestrel 19-nortestosteron türevi bir progestajendir ve hedef organlarda progesteron reseptörlerine yüksek afinite ile bağlanır.
Etinilestradiol kontraseptif ürünlerde yaygın olarak kullanılan bir estrojendir. NuvaRİng'İn kontraseptif etkisi en önemlisi ovulasyon inhibisyonu (yani yumurtlamayı önleyici) olan çeşitli mekanizmalara dayanmaktadır.
NuvaRing, oral kombine kontraseptiflere benzer şekilde hamileliğe karşı koruma sağlamanın yanında, doğum kontrolü yöntemi kararında yararlı olabilecek çeşitli olumlu özelliklere de sahiptir. Siklüs daha düzenlidir ve menstruasyon sıklıkla daha az ağrılı ve kanama daha hafiftir. Kanamanın azlığı demir yetersizliği oluşumunu azaltabilir.
FARMAKOKİNETİK ÖZELLİKLER
1. Etonogestrel
ABSORBSİYON
NuvaRing'den salınan etonogestrel vajinal mukozadan hızlı absorbe edilmektedir. Yaklaşık 1700 pg/mL olan maksimum etonogestrel serum konsantrasyonlarına yerleştirmeyi izleyen yaklaşık 1 hafta içinde ulaşılır.
Serum konsantrasyonları küçük dalgalanmalar gösterir ve kademeli olarak 3 hafta sonunda yaklaşık 1400 pg/mL'ye düşer. Mutlak biyoyararlanım oral uygulama sonrasına göre daha yüksek olarak yaklaşık % 100'dür.
DAĞILIM
Etonogestrel serum albumine ve seks hormonu bağlayan globuline (SHBG) bağlanmaktadır. Etonogestrel dağılımının hacmi 2.3 L/kg'dir.
METABOLİZMA
Etonogestrel bilinen steroid metabolizma yollarından metabolize edilmektedir. Serum klirensi 3.5 L/h dolayındadır. Birlikte uygulanan etinilestradiol ile doğrudan hiçbir etkileşimi bulunmamıştır.
ELİMİN ASYON
Etonogestrel serum düzeyleri iki evrede düşmektedir. Terminal eliminasyon evresinin yarı ömrü yaklaşık 29 saattir. Etonogestrel ve metabolitleri 1.7; I dolayındaki bir üriner-biliyer oranı ile atılmaktadır. Metabolit atılımı yarı ömrü yaklaşık 6 gündür.
2. Etinilestradiol
ABSORBSİYON
NuvaRing tarafından salınan etinilestradiol vajinal mukoza tarafından hızla absorbe edilmektedir.
Maksimum serum konsantrasyonları yerleştirmeden 3 hafta sonra 35 pg/mL dolayında elde edilir ve 3 hafta sonra 18 pg/mL'ye geriler. Mutlak biyoyararlanım etinilestradiolün oral uygulamasına benzer olarak yaklaşık % 56'dır.
DAĞILIM
Etinilestradiol serum albumine yüksek ölçüde ancak spesifik olmayarak bağlanır. Dağılım hacmi yaklaşık 15 L/kg'dır.
METABOLİZMA
Etinilestradiolün aromatik hidroksilasyonu sonucu hidroksillenmiş ve metillenmiş metabolitler oluşmaktadır. Bunlar serbest metabolitler olarak sülfat ve gfukuronid konjugatları halindedir. Klirens 35 L/h dolayındadır.
ELİMİNASYON
Etinilestradiol'ün serum düzeyleri iki evrede düşmektedir. Eliminasyon yarılanma ömrü bireysel farklılıklar göstermek ile birlikte ortalama değer yaklaşık 34 saattir. Değişime uğramadan ilaç atılımı söz konusu değildir. Etinilestradiol metabolitleri 1.3:1 üriner-biliyer oranında atılmaktadır. Metabolit atılımı yarı ömrü 1.5 gün dolayındadır.
GÜVENİRLİLİK VERİLERİ
Güvenilirlik farmakolojisi, tekrar doz toksisitesi, genotoksisite, karsinojenik potansiyel ve üreme toksİsitesİ alanlarında yapılan konvansiyel çalışmalara dayanan klinik öncesi veriler, etonogestrel ve etinilestradiol'ün insanlarda zararlı bir etki oluşturmadığını göstermektedir. Ancak, seks steroidlerinin belli hormon-bağımlı doku ve tümörlerin büyümesini arttırdığı unutulmamalıdır.
ENDİKASYONLAR
Kontrasepsiyon (Gebelikten korunma)
KONTRENDİKASYONLAR
NuvaRing aşağıda belirtilen koşulların herhangi birinin varlığında kullanılmamalıdır. NuvaRing kullanımı sırasında bu koşullardan herhangi biri ilk kez ortaya çıktığında halka derhal çıkartılmalıdır.
Venöz veya arteryel tromboz/tromboembolik vakaların veya derin venöz trombozu, akciğer embolisi veya miyokard infarktı şeklinde serebrovasküler hastalıkların varlığı ya da öyküsü.
Bir tromboz (örn. geçici iskemik atak, anjina pektoris) tehdidinin varlığı ya da öyküsü.
Fokal nörolojik semptomlar ile migren öyküsü.
Vasküler tutulumlu diabetes mellitus.
Venöz ya da arteriyel tromboza ilişkin yüksek ya da multipl risk faktörü ya da faktörlerinin varlığı bir kontrendikasyon da oluşturabilir ("Özel kullanım uyarıları ve özel önlemler" başlığı altına bakınız).
Pankreatit veya ciddi hipertrigliseridemi ile bağlantılı Pankreatİt öyküsü.
Karaciğer değerlen normale dönmediği sürece ciddi hepatik rahatsızlığının varlığı veya öyküsü. Karaciğer tümörünün (benign ya da malign) varlığı ya da öyküsü.
Bilinen veya kuşkulanılan seks-steroid etkili malign tümörler (genital organlarda veya memelerde).
Tanısı konmamış vajinal kanama.
Bilinen veya kuşkulanılan gebelik.
NuvaRing aktif bileşenlerine ya da herhangi bir katkı maddesine aşırı duyarlılık.
UYARILAR /ÖNLEMLER UYARILAR
Aşağıda belirtilen durumlar ya da risk faktörlerinden herhangi bîrinin varlığında, NuvaRing kullanımının yararları her bir kadındaki olası risklere karşı değerlendirilmeli ve kullanıma başlama kararı alması öncesinde kendisi ile görüşülmelidir.
Bu durumlar ya da risk faktörlerinin herhangi birinde ağırlaşma, şiddetlenme ya da ilk kez ortaya çıkma söz konusu olduğunda kadın derhal hekimi ile temasa geçmelidir.
Hekim daha sonra kullanıma devam konusunda karar verecektir. Aşağıda sunulan verilerin tümü kombine oral kontraseptifler (KOK) ile elde edilen epidemiyolojik verilere dayanmaktadır. Hormonların vajinal uygulama yolu üzerine herhangi bir epidemiyolojik veri bulunmamakla birlikte uyarıların NuvaRing kullanımına da uyarlanabilir olduğu düşünülmektedir.
1. Dolaşım bozuklukları
Epidemiyolojik deneyler kombine oral kontraseptif (KOK) kullanımı ile myokardiyal nekroz oluşması, felç, derin venöz trombozu ve akciğer embolisi gibi artan arteriyal ve venöz trombotik ve tromboembolik rahatsızlıklar riski arasında bir bağlantı kurmuştur. Bunlar nadiren gerçekleşir.
Derin ven trombozu ve/veya akciğer embolisi gibi ortaya çıkan venöz tromboembolizm (VTE) tüm hormonal kontraseptiflerin kullanımı sırasında görülebilir. Düşük estrojen dozajlı OK'leri (<0.050 mg EE) kullanıcılarındaki VTE'nin yaklaşık görülüş sıklığı, OK kullanıcısı olmayan 10.000 kadın yıl başına 0.5-3 ile kıyaslandığında 10.000 kadın başına en fazla 4'e kadardır. Hamilelik ve ilişkili VTE'nin görülme sıklığı 10.000 hamile kadın yıl başına 6'dır.
KOK kullanıcılarında hepatik, mezenterik, renal, serebral ya da retinal venler ve arterler gibi diğer kan damarlarında son derece seyrek olarak tromboz bildirilmiştir. Bu oluşumların KOK kullanımı İle ilişkisi konusunda bir fikir birliği bulunmamaktadır.
Venöz ve arter trombozu/tromboembolizm vakalar veya serebrovasküler olayların semptomları şunlar olabilir:
Tek taraflı bacak ağrısı ve/veya şişkinliği; sol kola yayılan ya da yayılmayan ani ve şiddetli göğüs ağrısı; ani soluk kesilmesi; ani öksürük başlangıcı; herhangi bir olağandışı, şiddetli ve uzun süreli baş ağrısı; ani kısmi ya da tam görme kaybı; diplopi, konuşma bozukluğu ya da afazi; vertigo; fokal nöbet gösteren ya da göstermeyen çöküntü hali; vücudun bir yanını ya da bir bölümünü aniden etkileyen halsizlik ya da çok belirgin uyuşukluk; motor bozukluklar; "akut" batın.
Venöz veya arteriyel trombotik/tromboembolik olaylar veya serebrovasküler olayların gelişme riski artış nedenleri:
- Yaş
- Sigara (özellikle 35 yaş üzeri kadınlarda yoğun sigara tüketimi ve artan yaş ile risk daha da artış gösterir.)
- Pozitif bir aile öyküsü (örn: göreceli erken yaşta bir kardeş veya ebeveynde venöz tromboembolizm). Kalıtsal bir yatkınlıktan kuşkulanılan durumlarda kadın herhangi bir hormonal kontraseptif kullanımına başlamadan önce bir hekime başvurmalıdır.
- Dislipoproteinemi
- Obezite (vücut kitie endeksi >30 mg/m1)
- Migren;
- Hipertansiyon
- Kalp kapağı hastalığı
- Atriyal Fibrilasyon;
Uzun süreli hareketsizlik, ciddi bir cerrahi girişim, bacaklarda herhangi bir cerrahi ya da ciddi bir travma gibi durumlarda kullanımın kesilmesi, elektif cerrahi durumunda en az dört hafta öncesinden yine kullanımının kesilmesi ve yeniden tam hareketlilik kazanılmasını izleyen en az iki hafta sonrasına kadar yeniden başlanmamalıdır;
Lohusalıkta artmış tromboembolizm riski düşünülmelidir, (bkz. Gebelik ve Emzirme Döneminde Kullanım)
Dolaşım bozuklukları ile ilişkili diğer tıbbi durumların içine diabetes mellitus, sistemik lupus eritematozus, hemolitik üremik sendrom, kronik enflamatuvar bağırsak hastalığı (örn: Crohn hastalığı ya da ülseratif kolit) ve orak hücre rahatsızlığı girmektedir.
Hormonal kontraseptif kullanımı sırasında migren sıklığı ve şiddetinde bir artış (serebrovasküler bir olayın habercisi olabilir) NuvaRing kullanımının aniden kesilmesini gerektirebilir.
Venöz ve arteriyel tromboz kalıtsal ya da edinilmiş yatkınlık göstergeleri olabilecek biyokimyasal faktörler Aktif Protein C (APC) direnci, hiperhomosisteinemi, antitrombin-lll eksikliği, protein C eksikliği, protein S eksikliği ve antifosfolipid antikorları (antikteardioiipin antikorları, lupus antikoagülan).
Doktor risk/fayda ilişkisini dikkate alırken, bir durumun yeterli tedavisinin tromboz ile ilişkili riskini azaltabileceğini ve hamilelik ile ilişkili riskin hormonal kontraseptif kullanımı ile ilişkili olandan daha yüksek olduğunu göz önünde bulundurmalıdır.
2. Tümörler
Meme kanserinin 40 yaş altı kadınlarda seyrek görülmesinden ötürü, halen ya da yakın tarihlerde KOK kullananlarda yüksek meme kanseri tanı sayısı meme kanseri genel riskine kıyasla düşük olmaktadır.
Seyrek olgularda KOK kullanıcılarında benign karaciğer tümörleri ve daha seyrek olarak malign karaciğer tümörleri bildirilmiştir. İzole olgularda bu tümörler yaşamı tehdit eden intra-abdominal hemorajilere yol açmıştır. Bu nedenle, NuvaRing kullanan kadınlarda ciddi üst abdomen ağrısı, karaciğer büyümesi ya da intraabdominal hemoraji belirtileri oluşması durumunda ayırıcı tanıda karaciğer tümörü düşünülmelidir.
3. Diğer Durumlar
Hipertrigliseridemisi ya da bu hastalıkla ilgili aile öyküsü bulunan kadınlar hormonal kontraseptif kullandıklarında yüksek pankreatit riski altında olabilirler.
Hormonal kontraseptif kullanan kadınların kan basınçlarında küçük artışlar bildirilmiş olmasına karşın, klinik olarak önemli artışlar seyrektir. Hormonal kontraseptif kullanımı ve klinik hipertansiyon arasında kesin bir ilişki kanıtlanmış değildir. Bununla birlikte, NuvaRing kullanımı sırasında sürekli ve klinik olarak anlamlı bir hipertansiyon gelişirse hekimin halka kullanımını askıya alması ve hipertansiyonu tedavi etmesi doğru olacaktır. Antihipertansif tedavi ile normotansif değerler elde edilirse ve uygun görülen durumlarda NuvaRing kullanımına yeniden başlanabilir.
Gerek hamilelik gerekse hormonal kontraseptif kullanımı sırasında aşağıdaki durumlara ilişkin belirti ya da kötüleşme bildirilmiş olmakla birlikte kullanımı ile İlişkinin kanıtı kesin değildir. Kolestaza bağlı sarılık ve kaşıntı, safra taşı oluşumu, porfiri, sistemik lupus eritematozus, hemolitik üremik sendrom, Sydenham koresi, herpes gestationis, otoskleroz ilişkili işitme kaybı.
Akut ya da kronik karaciğer bozukluklarında karaciğer fonksiyon testleri normale dönene kadar NuvaRing kullanımına ara verilmesi gerekebilir. İlk olarak hamilelik ya da daha önce seks steroidi kullanımları sırasında ortaya çıkmış olan kolestatik sarılık ve/veya kolestaz ile ilişkili pruritin tekrarlaması halka kullanımının bırakılmasını gerektirebilir.
Estrojen ve progesteronların periferik insülin direnci ve glikoz toleransı üzerine bir etkisi olabilse de düşük dozlu (<0.050 mg etinilestradiol) hormona! kontraseptif kullanan diabetiklerde değişiklik gereğine işaret eden bir kanıt bulunmamaktadır. Bununla birlikte, NuvaRing kullanan diabetik kadınlar özellikle ilk kullanım aylarında dikkatle izlenmelidir.
Crohn hastalığında ve ülseratif kolitte, hormonal kontraseptif kullanımı ile ilişkin bir kötüleşme bildirilmiştir.
Özellikle chloasma gravidarum öyküsü bulunan kadınlarda tek tük olarak chloasma oluşabilir. Chloasma'ya eğimli kadınlarda NuvaRing kullanırken güneş ya da ultraviyole ışınlarına mazur kalmaktan kaçınmalıdır.
Uterus prolapsusu, sistosel ve/veya rektosel, ciddi ya da kronik konstipasyon olan kadınlar NuvaRing'i doğru olarak yerleştirmede başarılı olmayabilir ya da halkayı kaybedebilirler.
NuvaRing kullanımı sırasında kadınlar çok seyrek olarak vajinit yaşayabilirler. Ne Nuvaring etkinliğinin vajinit tedavisinden etkilendiği ve ne de NuvaRing kullanımının vajinit tedavisini etkilediğine ilişkin bir endikasyon bulunmamaktadır.
TIBBİ MUAYENE / KONSÜLTASYON
NuvaRing ilk başta ve yeniden yerleştirilmeden önce eksiksiz bir tıbbi öykü alınmalı ve fiziksel muayene yapılmalıdır. Kontrendikasyon ve Uyarılar/Önlemler kılavuzluğunda periyodik olarak tekrarlanmalıdır.
Periyodik tıbbi kontrollerin bir başka önemi de kontrendikasyon lan n (örn. Geçici iskemik atak vs.) veya risk faktörlerinin (örn. Ailede venöz veya arteryel tromboz öyküsü) hormonal bir kontraseptifin kullanımı sırasında ilk kez ortaya çıkabilme olasılığıdır, Bu kontrollerin sıklığı ve yapısı belirlenirken, yerleşik klinik uygulamalar esas alınmalı ve her bir kadına göre özel olarak uyarlanacak ve genellikle de rutin servikal sitoİoji dahil, kan basıncı, memeler, karın ve pelvis organlarına özel dikkat gösterilmelidir.
ilaç etkileşmeleri, NuvaRing'in etkinliğini azaltabilir.
Kadınlara NuvaRing'in HIV infeksiyonlarına (AİDS) ve cinsel yoldan geçen diğer hastalıklara karşı koruma sağlamadığı belirtilmelidir.
AZALMIŞ ETKİNLİK
SİKLUS KONTROLÜNDE AZALMA
NuvaRing kullanımı sırasında düzensiz kanamalar (lekelenme ya da ara kanamalar) oluşabilir. Kanama düzensizliklerinin daha önce NuvaRing önerilen rejim uyarınca kullanılırken gerçekleşen düzenli sikluslar sonrasında oluşması durumunda hormon dışı nedenler düşünülmeli ve malignité ya da hamileliği NuvaRing ekarte etmek için uygun tanı önlemleri alınmalıdır. Bunlara kürtaj da dahil olabilir.
Bazı kadınlarda halkasız dönem sırasında bir çekilme kanaması oluşmayabilir. "Kullanım şekli ve dozu" bölümündeki talimatlar uyarınca kullanılırsa kadının hamileliği olası değildir. Bununla birlikte, olmadığı fark edilen ilk çekilme kanaması öncesinde NuvaRing'in ilgili talimatlara göre kullanılmamış olması ya da iki çekilme kanamasının atlandığının fark edilmesi durumunda, NuvaRing kullanmayı sürdürmeden önce hamilelik ekarte edilmelidir.
ERKEKLERİN ETİNİLESTRADİOL VE ETONOGESTREL'E TEPKİSİ
Cinsel partner olan erkeklerin, etinilestradiol ve etonogestrel'in penis vasıtasıyla emilmesi yoluyla maruz kaldıkları etkinin kapsamı ve muhtemel farmakolojik rolü henüz incelenmiş bir konu değildir.
GEBELİK EMZİRME DÖNEMİNDE KULLANIM
NuvaRing hamilelik sırasında endike değildir. Eğer hamilelik NuvaRing yerleştirilmiş halde gerçekleşirse, halka yerinden çıkartılmalıdır. Yaygın epidemiyolojik erken çalışmalar, hamilelik öncesinde KOK kullanmış kadınların doğurduğu çocuklarda doğum kusuru riski artışı ve KOK'ler hamilelik sırasında yanlışlıkla kullanıldığında bir teratojenik etki ortaya koymamıştır. Bunun tüm KOK'ler için geçerlilik taşıması yüksek olasılık olmakla birlikte NuvaRing için de söz konusu olup olmadığı açık değildir.
İntravajinal uygulama dolayısıyla, NuvaRing'deki kontraseptif steroidlerin intrautehn konsantrasyonları muhtemelen KOK kullanıcılarınınkilerinden daha yüksek olacaktır. Bu sebepten fetus üzerindeki etki ekarte edilemez. NuvaRing'e maruz kalmış gebeliklerin klinik sonuçlan bildirilmemiştir.
Emzirme, meme sütünün miktarını azaltabilen ve bileşimini değiştirebilen estrojenlerden etkilenebilmektedir. Bu nedenle, çocuk sütten tamamen kesilene kadar geçen sürede NuvaRing kullanımı genellikle önerilmemelidir. Küçük miktarlarda kontraseptif steroidler ve/veya metabolitleri süt ile atıalabilmektedir, ancak bunun bebeğin sağlığını olumsuz etkilediğine ilişkin bir kanıt bulunmamaktadır.
ARABA VE MAKİNE KULLANMA ÜZERİNE ETKİSİ
Gözlenmiş bir etkisi bulunmamaktadır.
YAN ETKİLERİ / ADVERS ETKİLER
Hormonal kontraseptiflerin kullanımı ile ilgili en ciddi istenmeyen etkiler "Uyanlar" bölümünde anlatılmıştır.
NuvaRing kullanıcıları tarafından bildirilmiş fakat ilişkisi ne reddedilmiş ne de teyit edilmiş olan diğer yan etkileri aşağıdaki gibidir:
Meme: Meme ağrısı (Mastalji)
Merkezi sinir sistemi: Baş ağrısı, migren, azalan libido, depresyon, ruhsal değişiklik baş dönmesi, anksiyete
Gastrointestinal Sistem: Mide bulantısı, abdominal ağrı, ishal, kusma
Cilt: Akne, genel kaşıntı, isilik
Uro-genital: Abdominal ağrı (jinekolojik), dismenore, vajinal akıntı, vajinal rahatsızlık, vajinitis, servisitis, sistit, üriner sistem enfeksiyonu
Diğer: Kilo alma, meme fibroadenosis, abdomen büyümesi, sırt ağrısı, yorgunluk
NuvaRing ile ilgili sorunlar; Kendiliğinden vajinadan çıkması, cinsel birleşme problemleri (kadın/erkek), yabancı cisim duygusu.
Beklenmeyen bir etki görüldüğü takdirde doktorunuza başvurunuz.
İLAÇ ETKİLEŞMELERİ ETKİLEŞİMLER
Hormonal kontraseptifler arasındaki ve diğer ilaç etkileşimleri ara kanamalara ve yetersiz kontrasepsiyona yol açabilir. Literatürde aşağıdaki etkileşimler bildirilmiştir.
Hepatik metabolizma: Seks hormonlarının klirensinde artışa sebep olan mikrozomal enzimleri indükleyen ilaçlarla etkileşimler ortaya çıkabilir (örn. Fenitoin, fenobarbital, pirimidon. karbamazepin, rifampisin ve muhtemelen de okskarbazepin. topiramat. felbamat. ritonavir, griseofulvin ve St. John's wort içeren ürünler).
Enterohepatik Dolaşım Çatışması: Bazı klinik raporlar, etinilestradiol konsantrasyonlarını (örn. Penisilinler, tetrasiklinler) azaltabilecek, belli antibiyotik maddeler verildiğinde enterohepatik estrojen dolaşımının azalabileceğini bildirmektedir. Bu ilaçları kullanan kadınların NuvaRing'e ilaveten geçici olarak ek bariyer me'todunu kullanmaları veya başka bir kontrasepsiyon metodunu seçmeleri önerilir.
Mikrozomal enzim indükleyici ilaçlarla bariyer metodu eş zamanlı ilaç uygulamaları sırasında ve ilacın kesilmesini izleyen 28 gün boyunca kullanılmalıdır. Antibiyotik (rifampisin ve griseofulvin) kullanan kadınlar, bunların kesilmesinden sonraki 7 güne kadar bariyer metodunu sürdürmelidirler. Eşzamanlı ilaç uygulamasının 3 haftalık bir halka siklusunu aşması durumunda, olağan halkasız dönem atlanarak derhal bir sonraki halka yerleştirilmelidir.
Farmakokinetik verileri esas aldığımızda, vajinal yoldan uygulanan antimikotikler ve spermisidlerin NuvaRing'in kontraseptif etkinliği ve güvenilirliğini etkileme olasılığı bulunmamaktadır.
Hormonal kontraseptifler diğer ilaçların metabolizması ile çatışabilir. Buna göre, plazma ve doku konsantrasyonları etkilenebilir (örn. Siklosporin)
Potansiyel etkileşimlerin tanımlanması amacıyla eş zamanlı ilaç uygulamalarının reçetesindeki bilgilere başvurulmalıdır.
LABORATUVAR TESTLERİ
Kontraseptif steroid kullanımı: karaciğer, tiroid, adrenal ve böbrek fonksiyonu, taşıyıcı proteinlerin (örn. koırikosteroid bağlayan globulin ve seks hormonu bağlayan globulin) plazma düzeyleri, lipid / lipoprotein fraskiyonları, karbonhidrat metabolizması parametreleri ve koagülasyon ve fibrinoliz parametreleri dahil belirli laboratuvar sonuçlarını etkileyebilmektedir. Değişimler genellikle normal laboratuvar aralıkları dahilinde kalmaktadır.
KULLANIM ŞEKLİ VE DOZU
NUVARING NASIL KULLANILIR?
NuvaRing vajinaya kadının kendisi tarafından yerleştirilebilir. Hekim, kadına NuvaRing yerleştirme ve çıkartma önerilerinde bulunmalıdır.
Yerleştirme sırasında kadın, bir bacağı kaldırma, çömelme ya da uzanma gibi kendisine en uygun pozisyonu seçecektir. NuvaRing iki yandan sıkıştırılmalı ve rahat hissedilene kadar vajina içine sokulmalıdır. NuvaRing'in vajina İçindeki kesin konumu halkanın kontraseptif etkisi açısından önemli değildir.
NuvaRing bir kez yerleştirildikten sonra (bkz."NUVARING KULLANMAYA NASIL BAŞLAMALI") 3 hafta boyunca sürekli olarak vajina içinde bırakılır. NuvaRing yanlışlıkla vajlnadan dışarı alındığında (örn. bir tampon çıkartma sırasında), soğuktan ılığa kadar (sıcak değil) sıcaklıkta su ile çalkalanarak derhal yeniden yerleştirilmelidir.
NuvaRing, yerleştirme sonrasında 3 hafta kullanıldıktan sonra yine haftanın aynı günü çıkartılmalıdır, (örn. halka Çarşamba günü saat 22:00 dolayında yerleştirilmiş ise 3 hafta sonra yine Çarşamba günü saat 22:00 dolayında çıkartılacaktır. Onu İzleyen Çarşamba günü yeni halka yerleştirilecektir.)
NuvaRing işaret parmağının kanca şeklinde kıvrılması ve halkanın işaret parmağı ve orta parmak arasında kavranması ve dışarı doğru çekilmesi yoluyla çıkartılabilir.
Kullanılmış halka çıkarıldıktan sonra ağzı yeniden kapatılabilen kendi poşetine yerleştirilmeli (çocuk ve ev hayvanlarından uzak tutunuz) ve ev atıklarıyla birlikte diğerlerinin yanlışlıkla temasını önleyecek şekilde atılmalıdır. NuvaRing klozet içinden sifon yoluyla atılmamalıdır.
NuvaRing'in çıkartılmasından genellikle 2-3 gün sonra çekilme kanaması başlar ve yeni halka yerleştirilene dek kesilmeyebilir.
NUVARİNG KULLANMAYA NASIL BAŞLANMALI
Önceki siklusta hormonal kontraseptif kullanılmadığında:
Menstrüasyonun ilk gününü " I. Gün" olarak kabul edin. NuvaRing I. Gün ve 5. Gün arası bir zamanda ancak kadının adet kanamasını sona ermemiş olması durumda dahi en geç siklusun 5. Gününde yerleştirilmelidir. NuvaRing kullanımının ilk 7 günü sırasında ek olarak prezervatif gibi bir bariyer yöntemi kullanımı önerilmektedir.
Bir kombine oral kontraseptiften geçiş yapmak:
Kadın NuvaRing'i en geç daha önce kullandığı kombine oral kontraseptifin olağan tabletsiz ya da plasebo tabletli dönemi sonrasındaki gün yerleştirmelidir.
Yalnızca progesteron içeren bir yöntemden (minipil, implant veya enjeksiyon) veya bir progestagen-salgılayan rahim içi araçtan geçiş yapmak:
Kadın minipil'den herhangi bir gün geçiş yapabilir, implanttan veya progestagen-salgılayan rahim İçi araçtan geçişlerde, implantın veya rahim içi aracın dışarı alındığı gün, enjeksiyon yönteminden geçişte ise bir sonraki enjeksiyonun uygulama tarihi seçilir. Bu olguların tamamında kadın İlk 7 gün boyunca ek bir bariyer yöntemi kullanmak durumundadır.
İlk trimester düşüğü sonrasında:
Kadın derhal kullanıma geçebilir. Bu geçiş yapıldığı takdirde ek kontraseptif önlem alma gereği ortadan kalkar. Derhal geçiş yapılması İstenmiyorsa "Önceki siklusta hormonal kontraseptif kullanılmadığında" başlığı altındaki öneriler dikkate alınmalıdır. Ara dönemde alternatif bir kontrasepsiyon yöntemi kullanılması önerilir.
Doğum ya da ikinci trimester düşüğü sonrasında:
Emziren kadın için Gebelik ve Emzirme Döneminde Kullanım'a bakınız. Kadınlara doğum ya da ikinci trimester düşüğünü izleyen dördüncü hafta sırasında kullanıma başlamaları önerilmelidir. Daha geç başlangıç yapan kadınlara NuvaRing kullanımının ilk 7 gününde ek bir bariyer yöntemi kullanmaları önerilmelidir.
Bununla birlikte, öncesinde cinsel ilişkisi bulunanlarda NuvaRing kullanmaya başlamadan önce hamilelik ekarte edilmeli ya da kadının ilk adet dönemi beklenmelidir.
ÖNERİLEN KULLANIM ŞEKLİNDEN SAPMALAR
Kadın önerilen kullanım şekline aykırı davranırsa kontraseptif etkinlik ve siklus kontrolü bozulabilir. Bu sapma durumunda kontraseptif etkinlik kaybını önlemek amacıyla şunlar önerilebilir.
Halkasız dönemin uzamış olması durumunda ne yapmalı:
Kadın anımsadıktan sonra derhal yeni bir halka yerleştirilmelidir. Yerleştirmeyi izleyen 7 gün boyunca prezervatif gibi ek bir bariyer yöntemi kullanılmalıdır.
Halkasız dönemde bir cinsel ilişki gerçekleşmiş ise hamilelik olasılığı düşünülmelidir. Hamilelik riski halkasız dönemin uzunluğu ölçüsünde yüksek olacaktır.
Halka geçici olarak vajina dışına çıkmış ise ne yapmalı:
NuvaRing 3 haftalık bir kesintisiz dönem boyunca vajina içinde bırakılmalıdır. Halka yanlışlıkla çıkarılmış ve dışarıda 3 saatten kısa bir süre boyunca kalmış ise kontraseptif etkinlikte bir azalma olmaz Kadın mümkün olan en kısa sürede ancak en geç 3 saat içinde halkayı yeniden yerleştirmelidir.
NuvaRing vajina dışında 3 saati aşan bir süre kaldığında kontraseptif etkinliğinde azalma olabilir. Kadın anımsamasını takiben halkayı derhal geri yerleştirmelidir. NuvaRing vajina içinde kesintisiz 7 gün bulunma süresi tamamlayana kadar, ek olarak prezervatif gibi bir bariyer yöntemi kullanılmalıdır.
Bu 7 günün ilk günleri halkanın üçüncü kullanım haftasına denk düşmesi, NuvaRing'in 3 haftadan daha uzun bir süre kullanılması gerektiği anlamına gelecektir. Halka daha sonra çıkartılmalı ve halkasız geçen bir haftalık aralık sonrasında yeni bir halka yerleştirilmelidir. Halka kullanımının ilk haftası sırasında halkanın 3 saati aşan sürelerde vajina dışında bulunması durumunda hamilelik dikkate alınmalıdır.
Halka kullanım süresi aşılmış ise ne yapılmalı:
NuvaRing maksimum 4 hafta süreyle kullanılırsa kontraseptif etkinlik korunmuş olur.
Kadın bir hafta süreli halkasız dönemi tamamladıktan sonra yeni bir halka yerleştirmelidir.
NuvaRing yerinde 4 haftadan uzun bir süre bırakıldığında kontraseptif etkinlik azalabilir ve yeni bir NuvaRing halkası yerleştirilmeden önce hamilelik ekarte edilmelidir.
Kadın önerilen rejime bağlı kalmamış ve sonrasında izleyen halkasız dönemde herhangi bir çekilme kanaması olmamış ise yeni bir NuvaRing yerleştirme öncesinde hamilelik ekarte edilmelidir.
ADET DÖNEMİ NASIL KAYDIRILIR YA DA NASIL GECİKTİRİLİR?
Bir dönemi geciktirmek isteyen bir kadın halkasız dönem geçirmeden yeni bir halka yerleştirebilir. Bir sonraki halka yine 3 hafta süreyle kullanılabilir. Kadın kanama ya da lekelenme yaşayabilir. Düzenli NuvaRing kullanımına daha sonra bir haftalık olağan halkasız dönemden sonra yeniden başlanır.
Dönemin olağan mevcut programında yer alandan başka bir hafta gününe kaydırmak isteyen kadına, bir sonraki halkasız dönemini İstediği sayıda gün kısaltması önerilebilir. Halkasiz dönem kısaldıkça kadının bi sonraki halka kullanımında çekilme kanaması olmaması ve ani kanama ya da lekelenme yaşaması riski artış göstermektedir.
DOZ AŞIMI
Hormonal kontraseptiflerin doz aşımının herhangi bilinen bir ciddi olumsuz etkisi yoktur. Bu durumlarda oluşabilecek semptomlar şunlardır: Mide bulantısı, kusma ve genç kadınlarda hafif vajinal kanama. Antidotu yoktur ve sonraki tedavi semptomatlk olmalıdır.
SAKLAMA KOŞULLARI
Hastaya satış öncesi: 36 ay, 2-8°C'de saklanmalıdır.
Satış sırasında: Eczacı kutu üzerine bir satış tarihi koyar. Ürün, önce geliş sırası esas alınarak satış tarihinden 4 ay sonra ya da son kullanım tarihinden sonra takılmamalıdır.
Satış sonrası: 4 ay, 30'C'nin altında saklanmalıdır.
Toplam raf ömrü: 40 ay
NuvaRing orijinal ambalajında saklanmalıdır.
TİCARİ TAKDİM ŞEKLİ
Bir adet NuvaRing içeren poşet, iç kısmı düşük yoğunlukta polletilen ve dış kısmı poliester kaplı alüminyum poşet, açılıp kapanabilir ve su geçirmezdir.
Poşet, baskılı karton kutuya prospektüs ile birlikte konmuştur.
Karton kutuda: 1 Vajinal halka içeren 1 poşet VEYA 1 Vajinal halka içeren 3 poşet.